Dünyayı etkisi altına alan koronavirüs salgınına çözüm üretebilecek aşı çalışmaları devam ediyor. Biotech ve Pfizer firmalarının ürettiği aşıya onay geldi. Aşının bulunma hızı vatandaşlarda endişeye sebep olmaya başladı. Peki aşıya neden güvenilmeli?
Evrim Ağacı’nın yayınladığı kapsamlı haberde, ayrıntılarıyla açıklanmaktadır. Evrim Ağacı’nın haberine göre;
Mart 2020'de Evrim Ağacı'nda yazdığımız üzere, COVID-19 aşısının en erken 12-18 ay içerisinde üretileceği, dolayısıyla 2021 yılından önce erişilebilir olmayacağı bilinmekteydi. Ancak bu süre bile, birçokları için aşırı kısa gözükmekteydi; çünkü aşı üretimi oldukça zorlu bir iştir. Çoğu zaman bir aşının üretilmesi yıllarca sürer. Bugüne kadar ürettiğimiz bazı aşıların üretim süreleri şu şekilde:
Suçiçeği Hastalığı: 28 yıl
FluMist Sprey Grip Aşısı: 28 yıl
İnsan Papillomavirüsü (HPV): 15 yıl
Rotavirüs: 15 yıl
Çocuk Kombinasyon Aşısı: 11 yıl
Kabakulak: 4 yıl
COVID-19 Hedefi: 12-18 ay
Dolayısıyla COVID-19 aşısı üretiminin de uzun sürmesi beklenirdi. Bu durumda, 12-18 ayda üretilecek bir aşının güvenli olacağından emin olabilir miyiz?
Öncelikle aşı geliştirmenin önemli birçok basamağı olduğunu hatırlamak gerekiyor. Bunları 5 gruba ayırabiliriz:
Hastalığın tanınması, eğer viral kökenli ise virüsün izolasyonu ve genomunun sekanslanması (dizilenmesi)
Laboratuvar şartlarında in vitro deneylerin yapılması
Hayvan modelinin bulunup in vivo deneylerin yapılması
Klinik deneyler
İmalat, patent, onay.
Bir diğer deyişle, aşılar önce hayvan dokularında ("hayvan deneyleri"), sonra çok küçük bir grup insanda (Faz 1 Klinik Deneyler), sonrasında giderek artan sayıda insan denekte (Faz 2, Faz 3 ve bazen Faz 4 Deneyler) deneniyor. Her bir basamakta sonuçlar ilan edilip, ek izinler alınıyor. Eğer yeterince başarılı sonuçlar üretilemezse, izinler iptal edilebiliyor. Aşağıda, üretilmek istenen ilaçların her bir fazda ne oranda başarılı olup, ne oranda başarısız olduğunu görebilirsiniz.
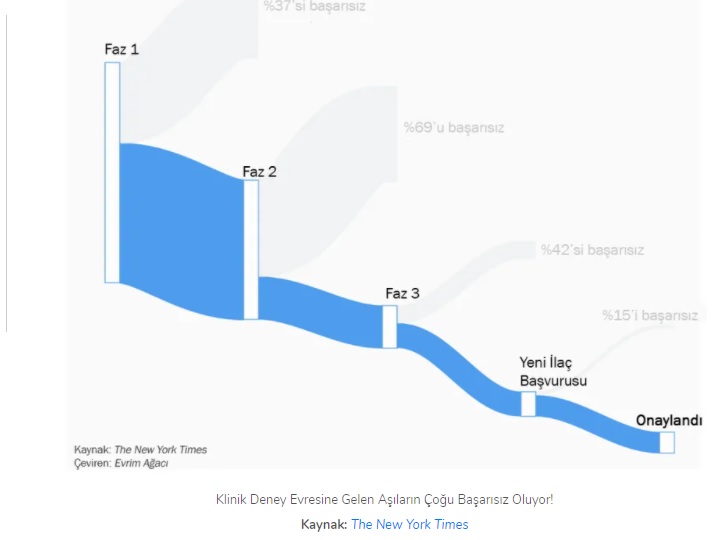
Yukarıda saydığımız evrelerin her birinde aşının geliştirilme süresi değişebilir: Virüsün cinsine göre, kullanılan teknolojiye göre, klinik deneylere hasta bulabilmek, ülkelerin bürokrasisine ve patent kurallarına göre süre uzayıp kısalabilir. Dolayısıyla COVID-19 aşısının bu kadar hızlı ve standart düzeyde güvenli bir şekilde üretilmesinin mümkün olup olmadığını anlamak için, tüm aşılara bir bütün olarak bakamayız. Bu aşının spesifik şartlarını değerlendirmemiz gerekir. Gelin, bunu yapalım:
2020 Salgını Öncesi, Olası Koronavirüs Salgını Hazırlığı
COVID-19 salgını başladığında, koronavirüsleri hakkında bilgimiz zaten vardı: İnsanları her sene enfekte eden 4 koronavirüsü var. Bunlara ek olarak, COVID-19 öncesinde tanıdığımız, 2002'teki SARS ve 2012'deki MERS'ten ötürü, koronavirüsler üzerine ciddi araştırmalar başlamıştı. Bu nedenle, en azından viroloji çevrelerinde yeni koronavirüs salgınlarını bekliyordu ve hazırlıklar yapılıyordu (hatta halk, tekrar tekrar uyarılmaya çalışılmıştı). COVID-19 salgını konusundaki belirgin başarısızlık, bilimsel bir eksiklikten ziyade, kamu sağlığı politikalarının zamanlı ve etraflı bir şekilde yerleştirilememiş olmasından kaynaklanmaktadır. Dolayısıyla viroloji ve immünoloji açısından pek bir eksiğimiz bulunmuyordu.
Şimdi, bunu görebilmek adına, aşı üretimindeki bazı önemli basamaklara tek tek bakalım ve işlerin COVID-19 için nasıl işlediğini öğrenelim.
1. Sekans (Gen Dizilemesi)
Çin’de ilk COVID-19 vakasının açıklanmasından 10 gün sonra virüsün genomu tamamen dizilendi. Bu, modern bilim ve teknoloji sayesinde mümkün oldu. Artık türlere ait genomları çok hızlı ve çok isabetli bir şekilde dizileyebiliyoruz. Bu nedenle 1990 yılında insan genomunu dizilemek 15 sene sürdü; AIDS semptomları ilk olarak 1981 senesinde tanınmış olmasına rağmen ilk tam HIV genomu 2009 senesinde yayınlandı; fakat COVID-19 genomunu dizilemek 10 gün sürdü.
Bu teknolojiler o kadar hızlı gelişiyor ki, kısa bir süre içerisinde ticari bir biçimde insanların kendi genomlarını kitlesel olarak dizilemesi mümkün olacak.
2. In Vitro Deneyler
Koronavirüsleri deneyleri zaten senelerdir yapılmaktadır. Hücre kültürü modelleri (Vero hücreleri) vardı ve hemen deneylere başlamak bu nedenle çok kolay oldu. Bu sayede COVID-19 hastası numunelerinden virüsü laboratuvarda izole etmek ve üzerinde çalışmak çok kolay oldu.
Koronavirüslerini önceden bildiğimiz için, SARS-CoV-2 virüsünün S kılıf proteini ile hücreye bağlandığı, ve 2002’deki SARS gibi hücredeki ACE2 reseptörünü kullandığı tahmin edilip çok çabuk ispatlandı. Eğer hiç aşina olmadığımız bir virüs olsaydı, hücreye giriş ve çoğalma mekanizmalarını çözmemiz daha uzun bir zaman alabilirdi. Fakat SARS-tipi virüsleri hem insanlarda, hem de yarasalar gibi diğer hayvanlarda uzun bir süredir tanıdığımız için, bu bilgilerimizi kullanarak aşıların S kılıf proteinine karşı yapılmasının en mantıklısı olduğu kısa bir sürede çözülebilmiş oldu.
3. In Vivo Hayvan Deneyleri
İnsan klinik deneylerine geçmeden önce, hayvanlar üzerinde yapılan COVID-19 deneyleri çok önemlidir. Örneğin SARS-CoV-2 virüsü, farelerin ACE2 reseptörünü tanıyamamaktadır. Bu yüzden virüsü farelere (veya fareleri virüse) adapte etmek gerekti ve bu da biraz zaman aldı.
Ancak modern bilim sayesinde "insanlaştırışmış fareler" artık elimizde bulunuyor. SARS-CoV-2 ile derhal insan ACE2 reseptörü olan fare model deneyleri başladı. Fareler dışında ayrıca Ferret (dağ gelinciği) modelleri de virolojide sıkça kullanılır ve SARS-CoV-2 için uygun modeller olduklarını hemen anladık. Makak modelleri de hazırdı.
4. Teknoloji
Eski virüs aşı teknolojileri, inaktive edilmiş veya zayıflatılmış virüsler kullanmaktadır. Bu, çok eski ve yavaş bir yöntemdir: Yeni bir salgında virüsün izole edilmesi ve laboratuvarda yeterli miktarda üretilmesi uzun sürüyor.
Fakat RNA teknolojisi sayesinde ilk COVID-19 vakasından sonra 10 gün içinde çıkan sekanstan yola çıkarak ilk RNA molekülleri 2 günde üretilebildi. 2000 senesinde kurulmuş CureVec ve senelerdir RNA aşı teknolojisi geliştiren benzer Moderna, BioNTech gibi şirketler sayesinde SARS-CoV-2 virüsüne karşı bir RNA aşısı geliştirmek zor olmadı.
Bu sayede ilk COVID-19 vakasından üç ay geçmeden, birinci faz insan deneyleri Moderna tarafından Mart 2020 sonunda başladı. Hatırlatma: RNA aşı teknolojisi 2008’den beri insanlarda deneniyor.
5. Klinik Deneyler
Bu evreye gelmeden önce akademik araştırma ve preklinik deneyler gerekiyor. Fakat SARS ve MERS deneyimleri sayesinde, ayrıca aşı teknolojilerinin önceden insanlarda denenmiş olması sayesinde COVID-19 başlangıcından klinik deneylerine kısa sürede geldik.
İlk Covid19’dan sonra ilk faz deneylere 3 ay, üçüncü faz deneylere de 6 ayda ulaştık. Bu, birkaç gelişme sayesinde gerçekleşti:
RNA aşıları 2008’den beri insanlarda deneniyordu
Oxford’un ürettiği ChAdOx1 viral vektör teknolojisi COVID-19’dan önce 330 kişide denenmişti.
SARS ve MERS deneyimleri sayesinde akademik araştırma çoktan başlamıştı ve pandemiye hazırdık.
Normalde bir aşının baştan sona gelişmesi için 400 milyon dolar gerekir ve bu parayı toplamak için süre lazım. Fakat pandemiden dolayı sermayenin akışı hızlandı.
2014 senesinde en ölümcül Ebola salgınını yaşadık ve bu, bilim dünyasında üzücü bir uyanışı sağladı: 28,616 vaka ve 11,310 ölüm yaşandı. Arkadından Dünya Sağlık Örgütü (DSÖ), Ebola aşısını geliştirmek için özel sektörün teşvik edilmesi gerektiğini belirtti. 2019 senesinde Ebola aşısı onaylandı.
Tüm bu gelişmeler, DSÖ’nün COVID-19 için uluslararası bir dayanışmaya dayalı klinik deneyleri başlatmasında yardımcı oldu. Ayrıca, aşı gelişmesinde kâr gütmeyen kuruluşlar sayesinde (ABD’de DARPA, Norveç’te CEPI, Avrupa’da PREPARE), bu alana yatırımlar devam etti.
6. Bürokrasi
Bu nokta, bu aşının normalden çok daha hızlı bir şekilde üretilebilmesinin ardında yatan ana nokta. Klinik deneylerin önemli bir bölümü, "bekleme" ile geçiyor; çünkü kurumlar, çeşitli fonlara ve araçlara başvurarak, değerlendirme süresi boyunca beklemeleri ve alacakları fona göre planlarını devreye sokmaları gerekiyor. Çünkü destekleyici bir kurum olmadıkça, bilimsel deneyler yapmak çok zordur, çok maliyetlidir. Araştırmacılar, başvurdukları bir fon reddedilirse, bir diğer fona başvurmaları gerekir; ancak o ret gelmeden bir diğer fona başvuramazlar. Dolayısıyla çok sayıda "bekleme fazı" araya girer. Ancak COVID-19'da bu tür bir sorun yoktu; herkes, salgını yenmek amacıyla bir araya geldi.
COVID-19 sayesinde ilk defa bu kadar sayıda ilaç şirketi, hükümetler, acentalar ve DSÖ, iş birliği içerisinde çalıştı. Aşının fakir ülkelere (92 üye ülke) dağıtımı için GAVI Aşı Birliği isimli kuruluş devreye girdi. Şirketler, aşının geliştirilmesinde tamamen bilimsel bir yol izleyeceklerine dair ve güvenilirlik verilerinden ödün vermeyeceklerine dair ortak bir yeminde bulundular.[1] Tıp tarihinde böyle bir şey önceden görülmedi.
Bu noktada, şunu hatırlamak çok önemli: Normalde aşı ve ilaçların onayı belli bürokratik prosedürlerden geçer. İstisnai durumlarda bir ilaç veya aşı acil kullanım yetkisi (İng: "Emergency Use Authorization" veya kısaca "EUA") veya merhametli kullanım (İng: "Compassionate Use") altında onay alabilir.
Aşının Güvenliği Nasıl Sağlanacak?
Pandemiden dolayı ABD’de ilaç ve aşı onaylayan FDA, COVID-19 aşılarına önce EUA (acil kullanım yetkisi) verecektir.[2] Eğer buna yönelik yetkilendirme dokümanını okursanız göreceksiniz ki, acil kullanım yetkisi için bile bir aşının teknolojisinden tutun, imalatına ve testine kadar, hatta imal edildiği binanın bulunduğu durum dahi istenmektedir. Adım adım takip edecek olursak:
Bu şartlar sadece içinde bulunduğumuz halk sağlığı acil durumu için geçerli. Acil durum geçtikten 60 gün sonra geçerliliğini yitirir.
COVID-19 aşısının gelişmesi bazı durumlarda hızlandırılabilir; ancak ve ancak benzer platformlar ve benzer ürünlerde deneyimimiz var ise.
Üretimin her aşamasından ve her dozun birbirine karşılaştırmalı olduğunu ve sürekliliğini gösteren veriler sunulmalı.
Her aşamada aşının niteliğini, saflığını, ve etkinliğini gösteren veriler sunulmalı.
Eğer gerekçe gösterilirse formülasyon ve doldurma işlemleri aşı onayından sonra da tamamlanabilir.
Aşının son kullanma tarihi hesaplanmalı ve en az üç farklı üretimde göster.
Aşı çalışmaları yapanların FDA ile erken iletişime geçmeleri, SARS ve MERS aşı gelişiminde hayvan deneylerinde görülen solunum sıkıntısı artışının bu aşıda görülmemesi için emin olunması.
Benzer platformlardan toksikoloji deneyimi varsa onlar sunulabilir.
Hamilelerin de aşı onayı alabilmesi için gelişim ve toksikoloji deneylerinin de tamamlanması gerekli.
ERD (ilerlemiş solunum hastalığı) olmaması için hayvan ve insan deneyi önergeleri var.
İlk insan deneyleri sağlıklı gönüllülerde ve COVID-19 riski az olanda.
Mümkünse ilk insan denemeleri SARS-CoV-2 kapma riski olan insanları (sağlık çalışanları) almamalı.
İnsan deneylerinde hem antikor hem de T hücre (Th1 ve Th2) polaeizasyonuna bakılmalı.
Onay için son faz deneylerde binlerce ve her durumdaki insanlarda olmalı.
Her yaş grubu için aşının: güvenliği, bağışıklığı, dozu, etkinliği, ve ERD riski (ilerlemiş solunum hastalığı) tespit edilmeli.
Aşının etkinliği ve güvenilirliği COVID-19 kapmış insanlarda da araştırılmalı.
Çocuklar ve hamileler için özel şartlar belirtilmiş.
Etkinlik deneyleri randomize ve çifte-kör olmalıdır.
Aynı deneyde tek plasebo grubuna kariı birden çok COVID-19 aşı aday grupları karşılaştırılabilir.
Eğer etkinliği ıspatlanmış aşı olursa plasebo grubunda etiksel sebepten dolayı o aşı kullanılabilir.
Etkinlik çalışmalarında uzun dönem takip yapılmalı.
Etkinlik çalışmasında labda onaylanmış COVID-19 tanısı veya SARS-CoV-2 enfeksiyonu yeterlidir.
Aşı onayı için ciddi COVID-19 önleyebilmek de yeterli olabileceği için deneyler bu hipotezi test edebilmeli.
Verilerin istatistiksel analizi için tavsiyeler verilmiş.
Aşının güvenliği için tavsiyeler verilmiş.
Bütün bu şartlar yerine getirildiğinde, hızlandırılmış onay (İng: "Accelerated Approval") mümkün olabilir. Eğer klinik hastalık verisi bir "endpoint" olarak gösterilemeyecek ise, o zaman insanlarda kontrollü enfeksiyon modelleri kabul edilebilir; fakat bunun etik ve bilimsel detayları ve insanların korunabilmesi durumu tartışılmalıdır. Henüz hiçbir kontrollü insan enfeksiyon modeli bulunmuyor.
Ama eğer ki tüm bu engeller aşılır ve gerekli şartlar yerine getirilirse, onaydan önce aşıya EUA ("acil kullanım yetkisi") getirilebilir.
Sonuç
En başta HPV aşısı 15 sene sürdü dedik. Fakat HPV, COVID-19'a benzer, acil bir pandemi olarak görülmedi ve bu yüzden çok daha farklı evrelerden geçti. Akademik deneylerde ilk önemli gelişme 1991 senesinde kaydedildi, HPV aşısı da nihayet 2006 senesinde onaylandı.
En başta, kabakulak aşısı, 4 sene ile en çabuk geliştirilen aşı dedik. Fakat bu, 1948 senesinde idi. Virüs 1945'te izole edildi ve ilk aşı (inaktive virüs aşısı) 1948 senesinde onaylanıp 1949’da dağıtıldı. Fakat yeteri kadar etkili olmadığı için, bırakıldı. Bugün kullanılan kabakulak aşısı 1977’de onaylandı.
HIV’ye hala aşı bulunamamasının sebebi yeteri kadar yatırım veya çaba harcanmadığı için değil, fakat virüsün biyolojisi ile alakalı. Benzer şekilde, çocuklarda en çok hastanelik olmaya sebep olan RSV’ye karşı 40 senedir hala aşı bulunamadı. Bunun sebebi de viral biyoloji...
COVID-19 için ise şanslıydık: Yukarıda bahsettiğimiz pek çok etken sayesinde yatırım olsun, bilim olsun, bürokrasi olsun, pandemiye hazırdık. Ayrıca aşı çalışmaları çok olumlu şekilde ilerliyor. Zika virüsüne mesela aşı bulmak çok zor, çünkü ADE isimli mekanizma yüzünden aşılar virüsün normalde enfekte olmayan hücreleri enfekte edebilmesini sağlıyor (antikor virüs ile hücre arasında köprü oluşturuyor).
Özetle, bilim tarihinde ilk defa bu hızda ama güvenilirlikten ödün vermeden bir aşının geliştirilmesine tanık oluyoruz. Önceki gelişmeler ve yatırımlar sayesinde, hükümetlerin işbirliği sayesinde seneler süren bir aşı bir sene sürüyor. Aşağıdaki görselde görüldüğü gibi, aşı gelişimindeki evreleri uç uca değil, ama yaratıcı bir şekilde üst üste koyarak süreyi kısaltabiliyoruz.